.jpg)
一、简述药品技术转让的概念和类型
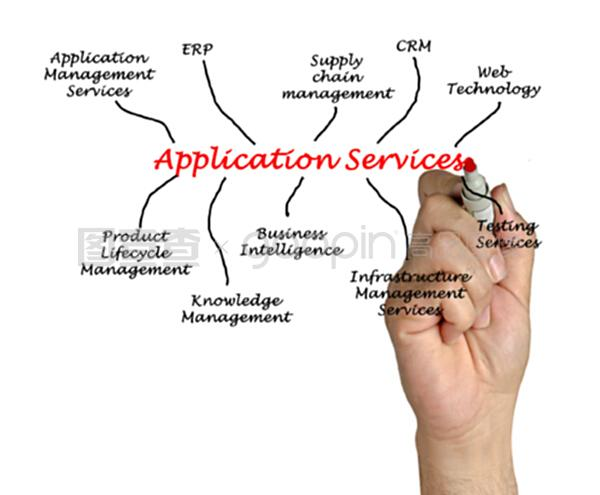
药品技术转让,是指药品技术的所有者按照本规定的要求,将药品生产技术转让给受让方药品生产企业,由受让方药品生产企业申请药品注册的过程。
药品技术转让分为新药技术转让和药品生产技术转让两种类型。
满意请采纳
二、简述药品技术转让的类型
新药技术转让、药品生产技术转让。药品技术转让分为新药技术转让和药品生产技术转让两种类型,均是转让全部药品生产技术,应遵循一致性和匹配性原则的前提。
三、国家药监局印发《药品技术转让注册管理规定》3
第四章 药品技术转让注册申请的申报和审批
第十四条 药品技术转让的受让方应当为药品生产企业,其受让的品种剂型应当与《药品生产许可证》中载明的生产范围一致。
第十五条 药品技术转让时,转让方应当将转让品种所有规格一次性转让给同一个受让方。
第十六条 麻醉药品、第一类精神药品、第二类精神药品原料药和药品类易制毒化学品不得进行技术转让。
第二类精神药品制剂申请技术转让的,受让方应当取得相应品种的定点生产资格。
放射性药品申请技术转让的,受让方应当取得相应品种的《放射性药品生产许可证》。
第十七条 申请药品技术转让,应当填写《药品补充申请表》,按照补充申请的程序和规定以及本规定附件的要求向受让方所在地省、自治区、直辖市药品监督管理部门报送有关资料和说明。
对于持有药品批准文号的,应当同时提交持有药品批准文号的药品生产企业提出注销所转让品种药品批准文号的申请。
对于持有《进口药品注册证》、同时持有用于境内分包装的大包装《进口药品注册证》的,应当同时提交转让方注销大包装《进口药品注册证》的申请。已经获得境内分包装批准证明文件的,还要提交境内分包装药品生产企业提出注销所转让品种境内分包装批准证明文件的申请。
对于已经获准药品委托生产的,应当同时提交药品监督管理部门同意终止委托生产的相关证明性文件。
第十八条 对于转让方和受让方位于不同省、自治区、直辖市的,转让方所在地省、自治区、直辖市药品监督管理部门应当提出审核意见。
第十九条 受让方所在地省、自治区、直辖市药品监督管理部门对药品技术转让的申报资料进行受理审查,组织对受让方药品生产企业进行生产现场检查,药品检验所应当对抽取的3批样品进行检验。
第二十条 国家食品药品监督管理局药品审评中心应当对申报药品技术转让的申报资料进行审评,作出技术审评意见,并依据样品生产现场检查报告和样品检验结果,形成综合意见。
第二十一条 国家食品药品监督管理局依据药品审评中心的综合意见,作出审批决定。符合规定的,发给《药品补充申请批件》及药品批准文号。
转让前已取得药品批准文号的,应同时注销转让方原药品批准文号。
转让前已取得用于境内分包装的大包装《进口药品注册证》、境内分包装批准证明文件的,应同时注销大包装《进口药品注册证》、境内分包装批准证明文件。
第二类精神药品制剂的技术转让获得批准后,转让方已经获得的该品种定点生产资格应当同时予以注销。
新药技术转让注册申请获得批准的,应当在《新药证书》原件上标注已批准技术转让的相关信息后予以返还;未获批准的,《新药证书》原件予以退还。
对于持有《进口药品注册证》进行技术转让获得批准的,应当在《进口药品注册证》原件上标注已批准技术转让的相关信息后予以返还。
需要进行临床试验的,发给《药物临床试验批件》;不符合规定的,发给《审批意见通知件》,并说明理由。
第二十二条 经审评需要进行临床试验的,其对照药品应当为转让方药品生产企业原有生产的、已上市销售的产品。转让方仅获得《新药证书》的,对照药品的选择应当按照《药品注册管理办法》的规定及有关技术指导原则执行。
第二十三条 完成临床试验后,受让方应当将临床试验资料报送国家食品药品监督管理局药品审评中心,同时报送所在地省、自治区、直辖市药品监督管理部门。省、自治区、直辖市药品监督管理部门应当组织对临床试验进行现场核查。
第二十四条 具有下列情形之一的,其药品技术转让注册申请不予受理,已经受理的不予批准:
(一)转让方或受让方相关合法登记失效,不能独立承担民事责任的;
(二)转让方和受让方不能提供有效批准证明文件的;
(三)在国家中药品种保护期内的;
(四)申报资料中,转让方名称等相关信息与《新药证书》或者药品批准文号持有者不一致,且不能提供相关批准证明文件的;
(五)转让方未按照药品批准证明文件等载明的有关要求,在规定时间内完成相关工作的;
(六)经国家食品药品监督管理局确认存在安全性问题的药品;
(七)国家食品药品监督管理局认为不予受理或者不予批准的其他情形。